辐射理论概要与激光产生条件
原子能级与简并度
原子的四个量子数
原子由带正电的原子核及绕核运动的电子组成;电子一方面绕核做轨道运动,一方面本身做自旋运动,如图所示。
原子中的电子状态是由四个量子数决定的:
主量子数n:(n=1,2,3,…)电子处于的壳层或者轨道;n越小,电子能量E越小;按能量最低原则排列
| 所取电子层(n) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| 符号表示 | K | L | M | N | O | P | Q |
| 最大电子数 | 2 | 8 | 18 | 32 | 32 |
辅量子数l:(l=1,2,3,…,n-1)电子处于不同轨道的角动量,同轨道的电子也存在能量差;
| 所取辅电子数(n) | 0 | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
| 符号表示 | s | p | d | f | g | h |
| 原子轨道形状 | 球形 | 杠铃形 | 花瓣形 |
磁量子数m:(m=0,,,…,)描述原子轨道在空间中的伸展方向,一个取值对应着一个伸展方向。
自旋量子数:()代表电子自旋方向的取向,指自旋而上的电子,反之,同时也代表电子自旋角动量在外磁场方向的分量。
最终原子能级
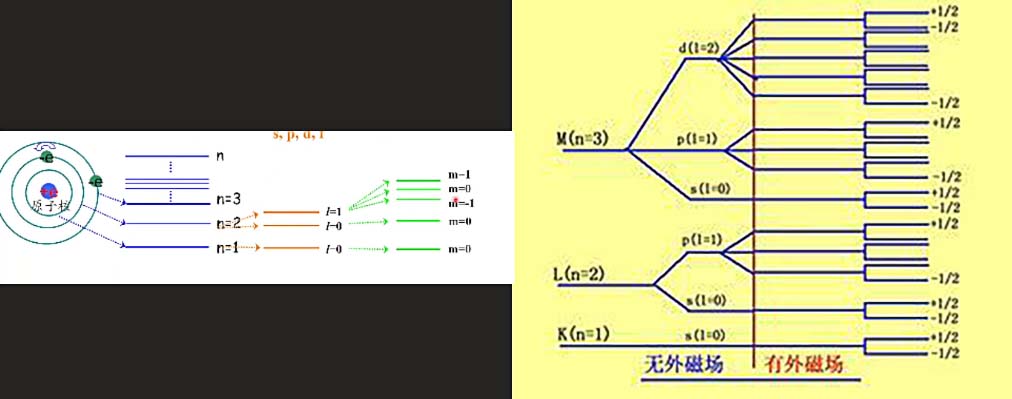
每个壳层都能分成n-1个辅量子轨道(亚电子层),根据磁量子数又可将一个辅量子轨道分为2l+1个伸展方向,每个伸展方向对应两个自旋方向。
磁量子数与自旋量子数与外加电场存在关系
| 壳层 | K | L | M | N |
|---|---|---|---|---|
| 子壳层 | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| 容纳电子 | 2 | 2 6 | 2 6 10 | 2 6 10 14 |
例:Li 有3个电子,表示为; Na有11个电子,表示为,最外层未被填满称为价电子。
上述只是层所能容纳的最大电子数,排布规律如下图所示,因而对于Ca而言,其电子排布为2882
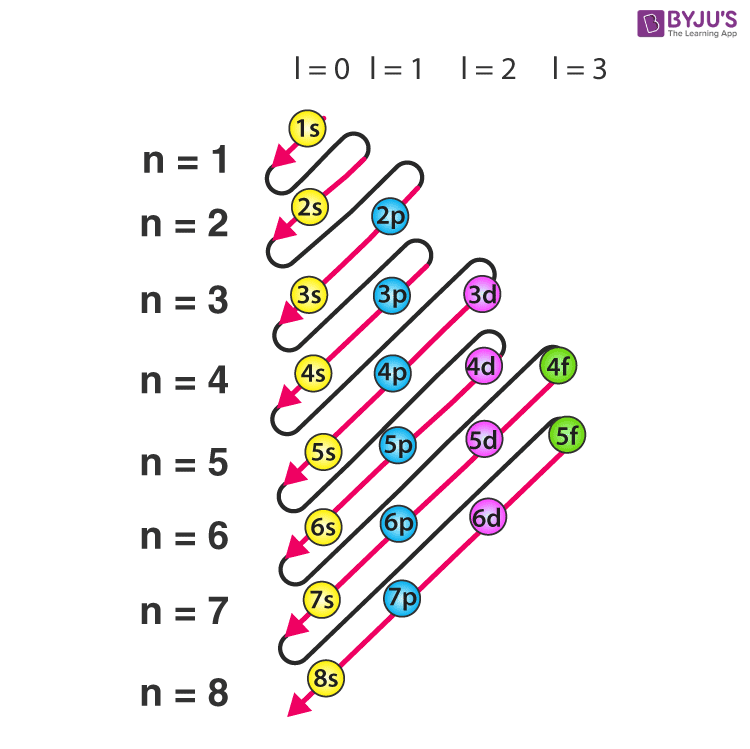
只有外层的价电子参与能级之间的辐射跃迁
三大排布规律
- 能量最低原则 :无外界激发情况下,电子充填原子壳层时,从最低的能级开始充填,再依次充填能量较高的能级。但,电子数较多的原子不一定严格按上述规则填充(电子间的相互作用导致量子数n和l的竞争)
- 泡利不相容原理 :不能有两个或两个以上的电子具有完全相同的四个量子数,描述的是自旋为半整数的粒子(费米子)。
- 洪特定则 :指原子核外电子的排布必先尽可能分占在同一辅量子层(亚电子层)的各个轨道上,且自旋方向相同。
简并
- 简并能级 :能级上存在两个或两个以上的不同运动状态
- 简并度 :能级上不同运动状态的数量,比如2p能级上存在3个磁量子数,和6个自旋电子,因此简并度为6
相干光子基本性质
光子性质
光子能量与光波频率的关系为:
光子的运动质量与能量关系为:
光子动量与光波矢量关系为:
光波模式及相格
分布规律及跃迁
玻尔兹曼分布
在热平衡条件下,由个相同原子构成的系统,原子数排布服从玻尔兹曼分布,能量越高,原子数越少,即:
其中为的简并度;k为玻尔兹曼常数,;T为热平衡时的开氏温度;为能级的原子数
不同(上下)能级的原子数必定满足下式:
两种跃迁方式
辐射跃迁:发射或吸收光子从而使原子造成能级间跃迁的现象。
非辐射跃迁:原子在不同能级跃迁时并不伴随光子的发射和吸收,而是把多余的能量传给了别的原子或吸收别的原子传给它的能量。
光波的三大辐射跃迁
自发辐射:高能级的原子自发地从高能级,向低能级跃迁,同时放出能量为,发出的光是朝各个方向的非相关光。自发辐射的平均寿命为,自发辐射的光功率密度为
受激辐射:当受到外来的能量等于的光照射时,高能级上的原子受到外来光的激励作用向低能级跃迁,同时发射一个与外来光子完全相同的光子。
受激吸收:处于低能级的原子在频率为v的辐射场激励下,吸收能量并向高能级跃迁的过程。


